เปปไทด์เป็นสารประกอบประเภทหนึ่งที่เกิดจากการเชื่อมต่อของกรดอะมิโนหลายชนิดผ่านพันธะเปปไทด์มีอยู่ทั่วไปในสิ่งมีชีวิตจนถึงขณะนี้มีการพบเปปไทด์นับหมื่นในสิ่งมีชีวิตเปปไทด์มีบทบาทสำคัญในการควบคุมกิจกรรมการทำงานของระบบ อวัยวะ เนื้อเยื่อและเซลล์ต่างๆ รวมถึงในชีวิต และมักใช้ในการวิเคราะห์การทำงาน การวิจัยแอนติบอดี การพัฒนายา และสาขาอื่นๆด้วยการพัฒนาเทคโนโลยีชีวภาพและเทคโนโลยีการสังเคราะห์เปปไทด์ จึงมีการพัฒนาและประยุกต์ใช้ยาเปปไทด์มากขึ้นในคลินิก
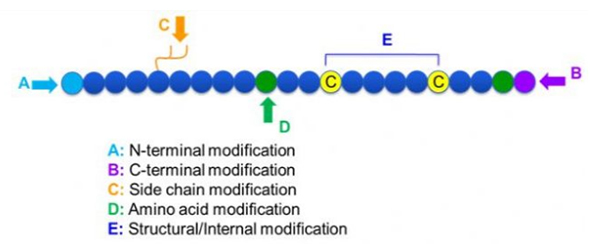
มีการดัดแปลงเปปไทด์ที่หลากหลาย ซึ่งสามารถแบ่งง่ายๆ เป็นการดัดแปลงภายหลังและการดัดแปลงกระบวนการ (โดยใช้การดัดแปลงกรดอะมิโนที่ได้รับ) และการดัดแปลงที่ปลาย N, การดัดแปลงที่ปลาย C, การดัดแปลงสายด้านข้าง, การดัดแปลงกรดอะมิโน, การดัดแปลงโครงกระดูก ฯลฯ ขึ้นอยู่กับสถานที่แก้ไข (รูปที่ 1)เนื่องจากเป็นวิธีสำคัญในการเปลี่ยนแปลงโครงสร้างสายโซ่หลักหรือกลุ่มสายด้านข้างของสายโซ่เปปไทด์ การปรับเปลี่ยนเปปไทด์จึงสามารถเปลี่ยนคุณสมบัติทางกายภาพและเคมีของสารประกอบเปปไทด์ได้อย่างมีประสิทธิภาพ เพิ่มความสามารถในการละลายน้ำ ยืดเวลาการออกฤทธิ์ในร่างกาย เปลี่ยนการกระจายตัวทางชีวภาพ ขจัดภูมิคุ้มกัน ลดผลข้างเคียงที่เป็นพิษ ฯลฯ ในบทความนี้ เราจะแนะนำกลยุทธ์การปรับเปลี่ยนเปปไทด์ที่สำคัญหลายประการและคุณลักษณะต่างๆ
1. การหมุนเวียน
เปปไทด์แบบไซคลิกมีการใช้งานหลายอย่างในชีวเวชศาสตร์ และเปปไทด์ธรรมชาติหลายชนิดที่มีฤทธิ์ทางชีวภาพคือเปปไทด์แบบไซคลิกเนื่องจากเปปไทด์ไซคลิกมีแนวโน้มที่จะเข้มงวดมากกว่าเปปไทด์เชิงเส้น จึงมีความทนทานต่อระบบย่อยอาหารอย่างมาก สามารถอยู่รอดได้ในระบบทางเดินอาหาร และแสดงความสัมพันธ์ที่ใกล้ชิดกับตัวรับเป้าหมายมากขึ้นการหมุนเวียนเป็นวิธีการสังเคราะห์เปปไทด์แบบไซคลิกโดยตรงที่สุด โดยเฉพาะอย่างยิ่งสำหรับเปปไทด์ที่มีโครงกระดูกโครงสร้างขนาดใหญ่ตามโหมดการหมุนเวียน สามารถแบ่งออกเป็นประเภทโซ่ฝั่งโซ่ด้านข้าง ประเภทเทอร์มินอล - โซ่ด้านข้าง เทอร์มินอล - ประเภทเทอร์มินัล (ประเภทจากปลายถึงปลาย)
(1) ไซด์เชนถึงไซด์เชน
ชนิดที่พบมากที่สุดของไซสเตอีนจากสายโซ่ด้านข้างถึงสายโซ่ด้านข้างคือการเชื่อมไดซัลไฟด์ระหว่างเรซิดิวซิสเทอีนการหมุนเวียนนี้เกิดขึ้นโดยคู่ของซิสเตอีนเรซิดิวที่ถูกกำจัดการป้องกัน จากนั้นออกซิไดซ์เพื่อสร้างพันธะไดซัลไฟด์การสังเคราะห์โพลีไซคลิกสามารถทำได้โดยการกำจัดกลุ่มป้องกันซัลไฮดริลแบบเลือกสรรการเกิดไซคลิกไลเซชันสามารถทำได้ในตัวทำละลายหลังการแยกตัวหรือบนเรซินก่อนการแยกตัวการหมุนเวียนบนเรซินอาจมีประสิทธิผลน้อยกว่าการหมุนเวียนของตัวทำละลาย เนื่องจากเปปไทด์บนเรซินไม่ก่อให้เกิดรูปแบบการหมุนเวียนโดยทันทีไซคลิกไลเซชันของสายโซ่ข้าง - โซ่ข้างอีกประเภทหนึ่งคือการก่อตัวของโครงสร้างเอไมด์ระหว่างกรดแอสปาร์ติกหรือกรดกลูตามิกตกค้างและกรดอะมิโนพื้นฐาน ซึ่งต้องการให้กลุ่มป้องกันสายโซ่ด้านข้างต้องสามารถเลือกเอาออกจากโพลีเปปไทด์ได้เช่นกัน บนเรซินหรือหลังการแยกตัวประเภทที่สามของห่วงโซ่ด้านข้าง - วงจรโซ่ด้านข้างคือการก่อตัวของไดฟีนิลอีเทอร์โดยไทโรซีนหรือ p-hydroxyphenylglycineการหมุนเวียนในผลิตภัณฑ์จากธรรมชาติประเภทนี้พบได้ในผลิตภัณฑ์จุลินทรีย์เท่านั้น และผลิตภัณฑ์การหมุนเวียนมักมีคุณค่าทางยาการเตรียมสารประกอบเหล่านี้ต้องมีเงื่อนไขการทำปฏิกิริยาเฉพาะ ดังนั้นจึงมักไม่ค่อยใช้ในการสังเคราะห์เปปไทด์ทั่วไป
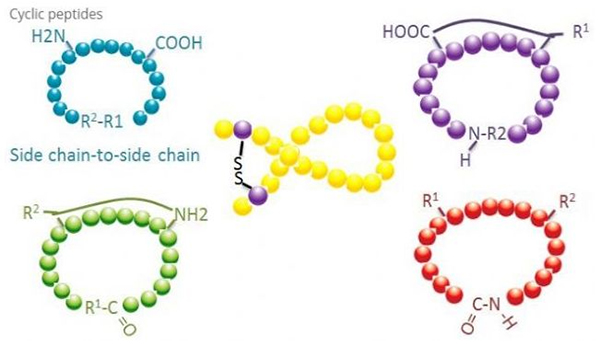
(2) เทอร์มินัลถึงไซด์เชน
ไซเคิลไลเซชันของสายโซ่ฝั่งปลายโดยปกติเกี่ยวข้องกับปลาย C กับหมู่อะมิโนของสายด้านข้างไลซีนหรือออร์นิทีน หรือปลาย N ที่มีสายด้านข้างของกรดแอสปาร์ติกหรือกรดกลูตามิกการเกิดปฏิกิริยาโพลีเปปไทด์แบบอื่นเกิดขึ้นโดยการสร้างพันธะอีเทอร์ระหว่างเทอร์มินัล C และสายด้านข้างซีรีนหรือทรีโอนีน
(3) เทอร์มินัลหรือแบบหัวถึงหาง
โพลีเปปไทด์สายโซ่สามารถถูกหมุนเวียนในตัวทำละลายหรือตรึงไว้บนเรซินโดยการหมุนเวียนสายโซ่ด้านข้างควรใช้เปปไทด์ที่มีความเข้มข้นต่ำในการรวมศูนย์ตัวทำละลายเพื่อหลีกเลี่ยงโอลิโกเมอไรเซชันของเปปไทด์ผลผลิตของโพลีเปปไทด์วงแหวนสังเคราะห์แบบหัวถึงหางขึ้นอยู่กับลำดับของโพลีเปปไทด์แบบสายโซ่ดังนั้น ก่อนที่จะเตรียมเปปไทด์แบบไซคลิกในวงกว้าง ควรสร้างคลังของเปปไทด์ตะกั่วที่เชื่อมโยงที่เป็นไปได้ก่อน ตามด้วยไซคลิกไลเซชันเพื่อค้นหาลำดับที่มีผลลัพธ์ที่ดีที่สุด
2. เอ็น-เมทิลเลชั่น
N-เมทิลเลชั่นเดิมเกิดขึ้นในเปปไทด์ธรรมชาติ และถูกนำมาใช้ในการสังเคราะห์เปปไทด์เพื่อป้องกันการก่อตัวของพันธะไฮโดรเจน ดังนั้นจึงทำให้เปปไทด์มีความทนทานต่อการย่อยสลายทางชีวภาพและการชำระล้างได้มากขึ้นการสังเคราะห์เปปไทด์โดยใช้อนุพันธ์ของกรดอะมิโน N-methylated เป็นวิธีการที่สำคัญที่สุดนอกจากนี้ ยังสามารถใช้ปฏิกิริยามิตซึโนบุของตัวกลางโพลีเปปไทด์-เรซิน N-(2-ไนโตรเบนซีน ซัลโฟนิล คลอไรด์) กับเมทานอลได้อีกด้วยวิธีการนี้ใช้ในการเตรียมไลบรารีเปปไทด์แบบไซคลิกที่มีกรดอะมิโนที่ถูกเติมด้วยเมทิล N
3. ฟอสโฟรีเลชั่น
ฟอสโฟรีเลชันเป็นหนึ่งในการดัดแปลงหลังการแปลที่พบมากที่สุดในธรรมชาติในเซลล์ของมนุษย์ โปรตีนมากกว่า 30% ถูกสร้างด้วยฟอสโฟรีเลชั่นฟอสโฟรีเลชัน โดยเฉพาะอย่างยิ่งฟอสโฟรีเลชันแบบผันกลับได้ มีบทบาทสำคัญในการควบคุมกระบวนการของเซลล์หลายอย่าง เช่น การส่งสัญญาณ การแสดงออกของยีน วัฏจักรของเซลล์และการควบคุมโครงกระดูกของโครงร่างเซลล์ และการตายของเซลล์
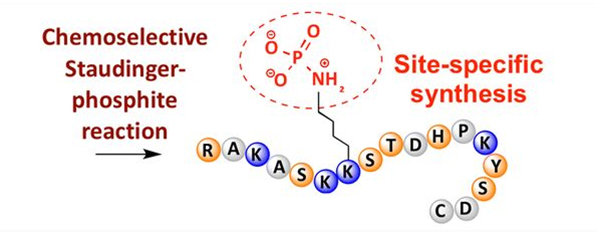
ฟอสโฟรีเลชันสามารถสังเกตได้จากสารตกค้างของกรดอะมิโนหลายชนิด แต่เป้าหมายฟอสโฟรีเลชั่นที่พบบ่อยที่สุดคือซีรีน ทรีโอนีน และไทโรซีนอนุพันธ์ฟอสโฟไทโรซีน, ฟอสโฟธรีโอนีน และฟอสโฟซีรีนสามารถนำเข้าไปในเปปไทด์ในระหว่างการสังเคราะห์หรือเกิดขึ้นหลังจากการสังเคราะห์เปปไทด์การคัดเลือกฟอสโฟรีเลชั่นสามารถทำได้โดยใช้สารตกค้างของซีรีน ธรีโอนีน และไทโรซีนที่คัดเลือกเอากลุ่มป้องกันออกรีเอเจนต์ฟอสโฟรีเลชันบางชนิดยังสามารถแนะนำหมู่กรดฟอสฟอริกเข้าไปในโพลีเปปไทด์โดยการดัดแปลงภายหลังในช่วงไม่กี่ปีที่ผ่านมา การเกิดฟอสโฟรีเลชั่นเฉพาะตำแหน่งของไลซีนสามารถทำได้โดยใช้ปฏิกิริยา Staudinger-phosphite ที่คัดเลือกทางเคมี (รูปที่ 3)
4. ไมริสโตเลชั่นและปาล์มมิโตเลชั่น
การเกิดอะซิเลชันของปลาย N ด้วยกรดไขมันทำให้เปปไทด์หรือโปรตีนจับกับเยื่อหุ้มเซลล์ได้ลำดับไมริดาโมอิเลตบนเทอร์มินัล N ช่วยให้ไคเนสโปรตีนตระกูล Src และโปรตีน Gaq แบบย้อนกลับสามารถกำหนดเป้าหมายเพื่อจับกับเยื่อหุ้มเซลล์กรดไมริสติกถูกเชื่อมโยงกับปลาย N ของเรซิน-โพลีเปปไทด์โดยใช้ปฏิกิริยาคู่ควบมาตรฐาน และไลโปเปปไทด์ที่เป็นผลลัพธ์สามารถถูกแยกตัวออกภายใต้สภาวะมาตรฐานและทำให้บริสุทธิ์โดย RP-HPLC
5. ไกลโคซิเลชั่น
ไกลโคเปปไทด์ เช่น แวนโคมัยซิน และเทโคลานิน เป็นยาปฏิชีวนะที่สำคัญสำหรับการรักษาโรคติดเชื้อแบคทีเรียที่ดื้อยา และไกลโคเปปไทด์อื่นๆ มักใช้เพื่อกระตุ้นระบบภูมิคุ้มกันนอกจากนี้ เนื่องจากแอนติเจนของจุลินทรีย์จำนวนมากมีไกลโคซิเลต จึงมีความสำคัญอย่างยิ่งในการศึกษาไกลโคเปปไทด์เพื่อปรับปรุงผลการรักษาของการติดเชื้อในทางกลับกัน พบว่าโปรตีนบนเยื่อหุ้มเซลล์ของเซลล์เนื้องอกแสดงไกลโคซิเลชันที่ผิดปกติ ซึ่งทำให้ไกลโคเปปไทด์มีบทบาทสำคัญในการวิจัยโรคมะเร็งและการป้องกันภูมิคุ้มกันของเนื้องอกไกลโคเปปไทด์เตรียมโดยวิธี Fmoc/t-Buสารตกค้างของไกลโคซิเลต เช่น ทรีโอนีนและซีรีน มักถูกใส่เข้าไปในโพลีเปปไทด์โดย fMOC ที่กระตุ้นการทำงานของเพนทาฟลูออโรฟีนอลเอสเตอร์ เพื่อปกป้องกรดอะมิโนที่ถูกไกลโคซิเลต
6. ไอโซพรีน
ไอโซเพนทาไดนิเลชันเกิดขึ้นกับซิสเทอีนเรซิดิวในสายด้านข้างใกล้กับปลาย Cไอโซพรีนของโปรตีนสามารถปรับปรุงความสัมพันธ์ของเยื่อหุ้มเซลล์และสร้างปฏิกิริยาระหว่างโปรตีนกับโปรตีนได้โปรตีนไอโซเพนทาไดเอต ได้แก่ ไทโรซีนฟอสฟาเตส, จีเตสขนาดเล็ก, โมเลกุลโคชาเปโรน, แผ่นนิวเคลียส และโปรตีนที่จับกับเซนโตรเมอร์ไอโซพรีนโพลีเปปไทด์สามารถเตรียมได้โดยใช้ไอโซพรีนบนเรซินหรือโดยการแนะนำอนุพันธ์ของซิสเทอีน
7. การดัดแปลงโพลีเอทิลีนไกลคอล (PEG)
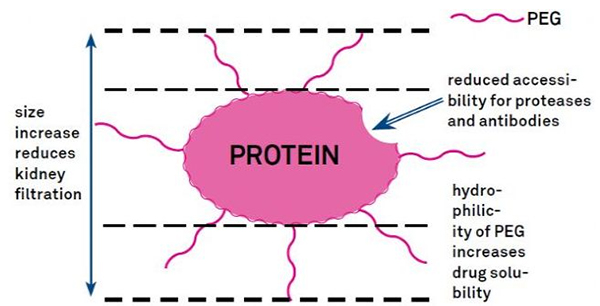
การดัดแปลง PEG สามารถใช้เพื่อปรับปรุงความคงตัวของโปรตีนไฮโดรไลติก การกระจายตัวทางชีวภาพ และการละลายของเปปไทด์การนำสายโซ่ PEG มาใช้กับเปปไทด์สามารถปรับปรุงคุณสมบัติทางเภสัชวิทยาของเปปไทด์ได้ และยังยับยั้งการไฮโดรไลซิสของเปปไทด์ด้วยเอนไซม์โปรตีโอไลติกเปปไทด์ PEG ผ่านส่วนตัดขวางของเส้นเลือดฝอยไตได้ง่ายกว่าเปปไทด์ทั่วไป ซึ่งช่วยลดการเคลื่อนตัวของไตได้อย่างมากเนื่องจากครึ่งชีวิตที่ออกฤทธิ์ยาวนานของเปปไทด์ PEG ในร่างกาย ทำให้สามารถรักษาระดับการรักษาตามปกติได้ด้วยขนาดที่ต่ำกว่าและใช้ยาเปปไทด์ที่ความถี่น้อยลงอย่างไรก็ตาม การปรับเปลี่ยน PEG ก็มีผลเสียเช่นกันPEG ในปริมาณมากจะป้องกันไม่ให้เอนไซม์ย่อยสลายเปปไทด์ และยังช่วยลดการจับกันของเปปไทด์กับตัวรับเป้าหมายอีกด้วยแต่ความสัมพันธ์ที่ต่ำของเปปไทด์ PEG มักจะถูกชดเชยด้วยครึ่งชีวิตทางเภสัชจลนศาสตร์ที่ยาวนานขึ้น และด้วยการอยู่ในร่างกายนานขึ้น เปปไทด์ PEG ก็มีแนวโน้มที่จะถูกดูดซึมเข้าสู่เนื้อเยื่อเป้าหมายมากขึ้นดังนั้น ควรปรับข้อมูลจำเพาะของโพลีเมอร์ PEG ให้เหมาะสมเพื่อให้ได้ผลลัพธ์ที่ดีที่สุดในทางกลับกัน เปปไทด์ PEG จะสะสมในตับเนื่องจากการกวาดล้างของไตลดลง ส่งผลให้เกิดกลุ่มอาการโมเลกุลขนาดใหญ่ดังนั้น การปรับเปลี่ยน PEG จึงต้องได้รับการออกแบบอย่างระมัดระวังมากขึ้นเมื่อใช้เปปไทด์ในการทดสอบยา
กลุ่มการดัดแปลงทั่วไปของตัวดัดแปลง PEG สามารถสรุปได้คร่าวๆ ดังนี้: อะมิโน (-เอมีน) -NH2, อะมิโนเมทิล-Ch2-NH2, ไฮดรอกซี-OH, คาร์บอกซี-คูห์, ซัลไฮดริล (-ไทออล) -SH, มาเลอิไมด์ -MAL, ซัคซินิไมด์คาร์บอเนต - SC, ซัคซินิไมด์อะซิเตต -SCM, ซัคซินิไมด์โพรพิโอเนต -SPA, n-ไฮดรอกซีซัคซินิไมด์ -NHS, อะคริเลต-ch2ch2cooh, อัลดีไฮด์ -CHO (เช่น โพรพินัล-อัลด์, บิวไทร์ALD), ฐานอะคริลิก (-อะคริเลต-อะคริล), อะซิโด-อะไซด์, ไบโอตินิล - ไบโอติน, ฟลูออเรสซีน, กลูทาริล -GA, อะคริเลตไฮดราไซด์, อัลไคน์-อัลไคน์, พี-โทลูอีนซัลโฟเนต -OTs, ซัคซินิไมด์ ซัคซิเนต -SS ฯลฯ อนุพันธ์ PEG กับกรดคาร์บอกซิลิกสามารถใช้ร่วมกับเอมีนที่ปลายเอ็นหรือสายโซ่ข้างไลซีนได้PEG ที่ถูกกระตุ้นด้วยอะมิโนสามารถถูกควบคู่กับสายด้านข้างของกรดแอสปาร์ติกหรือกรดกลูตามิกได้PEG ที่ถูกกระตุ้นด้วย Mal สามารถคอนจูเกตกับเมอร์แคปแทนของสายด้านข้างซิสเทอีนที่ถูกปลดการป้องกันอย่างสมบูรณ์ [11]ตัวดัดแปลง PEG โดยทั่วไปจะจำแนกได้ดังนี้ (หมายเหตุ: mPEG คือ methoxy-PEG, CH3O-(CH2CH2O)n-CH2CH2-OH) :
(1) ตัวดัดแปลง PEG โซ่ตรง
mPEG-SC, mPEG-SCM, mPEG-SPA, mPEG-OTs, mPEG-SH, mPEG-ALD, mPEG-butyrALD, mPEG-SS
(2) ตัวดัดแปลง PEG แบบสองฟังก์ชัน
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCl·NH2-PEG-COOH, MAL-PEG-NHS
(3) ตัวดัดแปลง PEG แบบแยกสาขา
(mPEG)2-NHS, (mPEG)2-ALD, (mPEG)2-NH2, (mPEG)2-MAL
8. ไบโอติไนซ์
ไบโอตินสามารถจับกันอย่างแน่นหนากับอะวิดินหรือสเตรปตะวิดิน และความแข็งแรงในการจับนั้นใกล้เคียงกับพันธะโควาเลนต์ด้วยซ้ำเปปไทด์ที่มีฉลากไบโอตินมักใช้ในการตรวจอิมมูโนแอสเสย์, ฮิสโตไซโตเคมี, และโฟลว์ไซโตเมทรีที่ใช้ฟลูออเรสเซนซ์แอนติไบโอตินแอนติบอดีที่มีฉลากยังสามารถใช้เพื่อจับเปปไทด์ที่มีไบโอทินิลได้ฉลากไบโอตินมักจะติดอยู่ที่สายด้านข้างไลซีนหรือขั้วต่อ Nกรด 6-aminocaproic มักใช้เป็นพันธะระหว่างเปปไทด์และไบโอตินพันธะมีความยืดหยุ่นในการยึดเกาะกับซับสเตรต และยึดเกาะได้ดีขึ้นเมื่อมีอุปสรรคแบบสเตอริก
9. การติดฉลากเรืองแสง
การติดฉลากฟลูออเรสเซนต์สามารถใช้เพื่อติดตามโพลีเปปไทด์ในเซลล์ที่มีชีวิต และเพื่อศึกษาเอนไซม์และกลไกการออกฤทธิ์ทริปโตเฟน (Trp) เป็นสารเรืองแสง จึงสามารถนำไปใช้ในการติดฉลากภายในได้สเปกตรัมการปล่อยทริปโตเฟนขึ้นอยู่กับสภาพแวดล้อมรอบข้างและลดลงตามขั้วของตัวทำละลายที่ลดลง ซึ่งเป็นคุณสมบัติที่มีประโยชน์ในการตรวจจับโครงสร้างของเปปไทด์และการจับตัวรับการเรืองแสงของโพรไบโอสามารถดับได้ด้วยกรดแอสปาร์ติกโปรตอนและกรดกลูตามิกซึ่งอาจจำกัดการใช้งานหมู่แดนซิลคลอไรด์ (แดนซิล) มีสารเรืองแสงสูงเมื่อจับกับหมู่อะมิโน และมักใช้เป็นฉลากเรืองแสงสำหรับกรดอะมิโนหรือโปรตีน
การแปลงพลังงานเรโซแนนซ์เรืองแสง (FRET) มีประโยชน์สำหรับการศึกษาเอนไซม์เมื่อ FRET ถูกปรับใช้ ซับสเตรตโพลีเปปไทด์โดยปกติประกอบด้วยหมู่ที่ติดฉลากเรืองแสงและหมู่ดับเรืองแสงกลุ่มฟลูออเรสเซนต์ที่มีป้ายกำกับจะถูกดับโดยเครื่องดับโดยการถ่ายโอนพลังงานที่ไม่ใช่โฟตอนเมื่อเปปไทด์ถูกแยกออกจากเอนไซม์ที่เป็นปัญหา กลุ่มการติดฉลากจะปล่อยสารเรืองแสงออกมา
10. โพลีเปปไทด์แบบเคจ
เปปไทด์เคจมีกลุ่มป้องกันที่ถอดออกได้ด้วยแสงซึ่งป้องกันเปปไทด์จากการจับกับตัวรับเมื่อสัมผัสกับรังสี UV เปปไทด์จะถูกกระตุ้นและฟื้นฟูความสัมพันธ์กับตัวรับเนื่องจากการกระตุ้นด้วยแสงนี้สามารถควบคุมได้ตามเวลา แอมพลิจูด หรือสถานที่ จึงสามารถใช้เปปไทด์แบบกรงเพื่อศึกษาปฏิกิริยาที่เกิดขึ้นในเซลล์ได้หมู่ป้องกันที่ใช้กันมากที่สุดสำหรับโพลีเปปไทด์ในกรงคือหมู่ 2-ไนโตรเบนซิลและอนุพันธ์ของพวกมัน ซึ่งสามารถนำไปใช้ในการสังเคราะห์เปปไทด์ผ่านอนุพันธ์ของกรดอะมิโนป้องกันอนุพันธ์ของกรดอะมิโนที่ได้รับการพัฒนา ได้แก่ ไลซีน, ซีสเตอีน, ซีรีน และไทโรซีนอย่างไรก็ตาม อนุพันธ์ของแอสพาร์เตตและกลูตาเมตไม่ได้ใช้กันทั่วไปเนื่องจากมีความอ่อนไหวต่อการเกิดไซคลิกไลเซชันระหว่างการสังเคราะห์เปปไทด์และการแยกตัวออกจากกัน
11. โพลีแอนติเจนเปปไทด์ (MAP)
เปปไทด์ชนิดสั้นมักไม่มีภูมิคุ้มกันและต้องใช้ร่วมกับโปรตีนพาหะจึงจะผลิตแอนติบอดีได้โพลีแอนติเจนิกเปปไทด์ (MAP) ประกอบด้วยเปปไทด์ที่เหมือนกันหลายตัวเชื่อมต่อกับนิวเคลียสไลซีน ซึ่งสามารถแสดงอิมมูโนเจนที่มีศักยภาพสูงโดยเฉพาะ และสามารถใช้เพื่อเตรียมโคปเลตโปรตีนที่เป็นพาหะของเปปไทด์ได้โพลีเปปไทด์ MAP สามารถสังเคราะห์ได้โดยการสังเคราะห์เฟสของแข็งบนเรซิน MAPอย่างไรก็ตาม การมีเพศสัมพันธ์ที่ไม่สมบูรณ์ส่งผลให้เกิดสายเปปไทด์หายไปหรือถูกตัดทอนในบางกิ่ง จึงไม่แสดงคุณสมบัติของโพลีเปปไทด์ MAP ดั้งเดิมอีกทางเลือกหนึ่งคือสามารถเตรียมเปปไทด์และทำให้บริสุทธิ์แยกจากกัน จากนั้นจึงจับคู่กับ MAPลำดับเปปไทด์ที่ติดอยู่กับแกนเปปไทด์นั้นถูกกำหนดไว้อย่างดีและมีลักษณะเฉพาะได้ง่ายด้วยแมสสเปกโตรเมตรี
บทสรุป
การดัดแปลงเปปไทด์เป็นวิธีสำคัญในการออกแบบเปปไทด์เปปไทด์ดัดแปลงทางเคมีไม่เพียงแต่สามารถรักษากิจกรรมทางชีวภาพในระดับสูงเท่านั้น แต่ยังหลีกเลี่ยงข้อเสียของภูมิคุ้มกันและความเป็นพิษได้อย่างมีประสิทธิภาพอีกด้วยในเวลาเดียวกัน การดัดแปลงทางเคมีสามารถทำให้เปปไทด์มีคุณสมบัติที่ดีเยี่ยมใหม่ๆ ได้ในช่วงไม่กี่ปีที่ผ่านมา วิธีการกระตุ้น CH สำหรับการดัดแปลงโพลีเปปไทด์หลังการดัดแปลงได้รับการพัฒนาอย่างรวดเร็ว และได้ผลลัพธ์ที่สำคัญมากมาย
เวลาโพสต์: 20 มี.ค.-2023
